COVID, FDA SCONFESSA CDC: OK A TAMPONI RT-PCR COI “RISCHI FALSI POSITIVI”. Esauriti Test Amazon: Affaroni su Omicron!

Amazon vince la scommessa sulla variante:
Già Esauriti i Tamponi RT-PCR
Autorizzati da FDA venerdì 17 dicembre
Per utilizzi domestici ma non solo
di Carlo Domenico Cristofori
Il 21 luglio 2021 è stata una data storica per i tamponi real-time RT PCR che persino il loro inventore Kary Banks Mullis, premio Nobel per la chimica nel 1993 proprio per la scoperta della tecnica di Reazione della Catena di Polimerasi (PCR), aveva consigliato di non usare per la diagnosi di patologie.
In quel giorno i Centers of Diseases Control and Prevention (CDC), massime autorità sanitarie di ogni stato americano, avvisarono i laboratori degli USA che avrebbero richiesto il ritiro dell’Autorizzazione all’Uso di Emergenza (EUA) di questa tipologia di test in quanto non sufficientemente specifici da distinguere il Covid-19 da un’influenza.
Fact-checkers dei media di mainstream, finanziati da Bill Gates per proteggere la narrativa internazionale sulla pandemia e l’allarme contagi volto a giustificare il business delle Big Pharma sui vaccini, si arrampicarono sui vetri dei grattacieli pur di depotenziare la portata del documento CDC che invitava i laboratori a trovare nuovi metodi di diagnosi, tra i quali i test in vitro IVD multiplex.
La bufera non è bastata ad attivare qualche autorità sanitaria europea per un’effettiva verifica sull’affidabilità dei tamponi: senza di essi non ci sono contagi e senza contagi, sebbene asintomatici ovvero equiparabili a falsi positivi fino a prova contraria, non c’è allarme, non si possono imporre restrizioni e di conseguenza nemmeno vaccinazioni obbligatorie…
Negli USA, invece, dove si vuol dare almeno una parvenza di serietà scientifica alla gestione della pandemia, la Food and Drug Administration si è data un gran da fare per difendere quei tamponi che rappresentano l’unica prova dell’impennata di contagi della variante Omicron negli USA, nel Regno Unito e nell’Unione Europea e il rilancio di una nuova stagione di restrizioni internazionali finalizzate a nuovi booster di sieri genici sperimentali (tranne in Nord America dove Comirnaty è già approvato definitivamente per gli over 18, seppur tra aspre polemiche).
In autunno, infatti, la FDA ha rilasciato molteplici EUA a kit diagnostici di differente tipologia che vanno dai classici e inaffidabili RT PCR, legittimati solo per controlli seriali con un curioso provvedimento “ombrello”, al sofisticato multiplex BioFire Respiratory Panel 2.1 (RP2.1) della Biofire Diagnostics, LLC di Salt Lake City, Utah, capace di identificare 5 tipi di coronavirus (tra cui SARS-Cov-2 ovviamente), 7 tipi di influenza e altre 7 infezioni virali delle vie respiratorie.
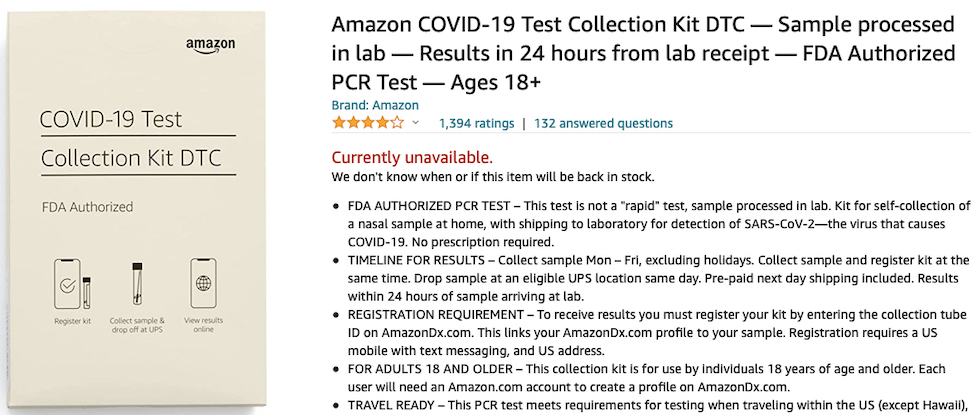
Fino ad arrivare all’autorizzazione del test domestico Amazon Multi-Target SARS-CoV-2 Real-Time RT-PCR DTC creato dalla STS Lab Holdco, una sussidiaria di Amazon.com Services LLC, andato esaurito in questi giorni sulla piattaforma del più grande rivenditore mondiale online.
Approvato ad uso esclusivo per i lavoratori Amazon nel marzo 2021, da agosto questo tampone ‘multi-target” è stato autorizzato anche per i test individuali a casa propria dall’EUA n. 210480 riconfermata il 17 dicembre 2021 da FDA con quattro autorizzazioni più ampie: non soltanto più per uso domestico. Dall’emergenza al business colossale il passo è sempre breve per i colossi Big Tech…
PANDEMIA, PERENNE REGIME DI TERRORE. Profetica Scomunica della Massoneria di Papa Leone XIII…
Al di là dei complessi aspetti burocratici, che analizzeremo nel dettaglio, la valenza diagnostica dei tamponi RT PCR, ritenuti inaffidabili nel 97 % dei casi da 3 ricerche scientifiche pubblicate su riviste specialistiche e la storica sentenza della Corte d’Appello di Lisbona, rimane comunque incerta come scrive la stessa FDA nei suoi documenti ufficiali nelle note A,B,C e D della “Dichiarazione limitante” contestuale all’approvazione del super tampone BioFire Respiratory Panel 2.1.
«Un risultato negativo del test non esclude la possibilità di infezione. I risultati del test devono essere interpretati insieme ad altri dati clinici e di laboratorio a disposizione del medico. Esiste il rischio di risultati errati a causa della presenza di varianti di sequenza di acido nucleico nei patogeni mirati; i valori predittivi positivi e negativi dipendono fortemente dalla prevalenza» ha scritto FDA da Silver Spring (MD) alla dottoressa Kristen Kanack, Vicepresidente senior, Affari regolatori e clinici della BioFire.
Ma in tutti i Fact Sheet (fogli informativi) dei test RT PCR approvati da FDA tra settembre e dicembre, dopo la richiesta di ritiro dei CDC, si fa comunque accenno al rischio che i tamponi nasali rilevino «falsi positivi» e qualche laboratorio avverte persino gli utenti sui seri rischi derivanti da tale circostanza: isolamento da parenti e amici, riduzione della possibilità di lavoro e prescrizione di trattamento o terapia.
IL SUPER TAMPONE MULTIPLEX DI BIO-FIRE NON E’ INFALLIBILE
«Il Center for Devices and Radiological Health (CDRH) della Food and Drug Administration (FDA) ha completato la revisione della vostra richiesta De Novo di classificazione del BioFire Respiratory Panel 2.1 (RP2.1), un dispositivo di prescrizione con le seguenti indicazioni per uso: Il pannello respiratorio BioFire 2.1 (RP2.1) è un test dell’acido nucleico multiplex basato su PCR destinato all’uso con i sistemi BioFire FilmArray 2.0 o BioFire FilmArray Torch per il rilevamento qualitativo simultaneo e l’identificazione di più acidi nucleici respiratori virali e batterici nei tamponi nasofaringei (NPS) ottenuti da individui sospettati di infezioni del tratto respiratorio, incluso COVID-19» si legge nella risposta di FDA a BioFire in relazione al suo test multitarget quale dispositivo diagnostico in vitro.
I seguenti tipi e sottotipi di organismi vengono identificati utilizzando BioFire RP2.1: adenovirus, Coronavirus 229E, Coronavirus HKU1, Coronavirus NL63, Coronavirus OC43, Sindrome respiratoria acuta grave Coronavirus (SARS-CoV-2), Metapneumovirus umano, Rinovirus umano/Enterovirus, Influenza A, compresi i sottotipi H1, H1-2009 e H3, Influenza B, virus parainfluenzale 1, virus parainfluenzale 2, virus parainfluenzale 3, virus parainfluenzale 4, Virus respiratorio sinciziale, Bordetella parapertussis (IS1001), Bordetella pertussis (ptxP), Chlamydia pneumoniae, e Mycoplasma pneumoniae.
«Il BioFire Respiratory Panel 2.1 (RP2.1) è stato esaminato nell’ambito del percorso di revisione pre-mercato De Novo, un percorso normativo per dispositivi a rischio da basso a moderato di un nuovo tipo. Insieme a questa autorizzazione De Novo, la FDA sta stabilendo criteri, chiamati controlli speciali, che definiscono i requisiti relativi all’etichettatura e ai test delle prestazioni» si legge nel sito ufficiale FDA che menziona l’autorizzazione del 17 marzo 2021.
Questa azione crea anche una nuova classificazione normativa, il che significa che dispositivi successivi dello stesso tipo con lo stesso uso previsto possono passare attraverso il percorso 510(k) della FDA, in base al quale i dispositivi possono ottenere l’autorizzazione dimostrando una sostanziale equivalenza a un dispositivo previsto.
Ai test diagnostici molecolari autorizzati per SARS-CoV-2 viene assegnato il codice prodotto QJR. Ai kit di raccolta domestica autorizzati viene assegnato il codice prodotto QLW. Agli EUA autorizzati per i test del pannello respiratorio multi-analitico viene assegnato il codice prodotto QLT. Tutto ciò lascia desumere una grande e completa affidabilità di questo test multiplex. Ma nella lettera di autorizzazione emergono varie criticità, già evidenziate in passato anche in Italia.

«Gli acidi nucleici degli organismi respiratori virali e batterici identificati da questo test sono generalmente rilevabili nei campioni di NPS durante la fase acuta dell’infezione. La rilevazione e l’identificazione di specifici acidi nucleici virali e batterici da individui che presentano segni e/o sintomi di infezione respiratoria è indicativa della presenza del microrganismo identificato e aiuta nella diagnosi di infezione respiratoria se utilizzata insieme ad altre informazioni cliniche ed epidemiologiche. I risultati di questo test non devono essere utilizzati come unica base per la diagnosi, il trattamento o altre decisioni sulla gestione del paziente».
E’ quanto afferma in modo inequivocabile il CDRH della FDA che aggiunge: «I risultati positivi non escludono la coinfezione con altri organismi. Gli agenti rilevati da BioFire RP2.1 potrebbero non essere la causa definitiva della malattia. Ulteriori test di laboratorio (ad es. coltura batterica e virale, immunofluorescenza e radiografia) possono essere necessari quando si valuta un paziente con possibile infezione del tratto respiratorio».
Il dispositivo «è concepito per aiutare nella diagnosi di infezione respiratoria in combinazione con altri dati clinici, epidemiologici e di laboratorio o altri fattori di rischio». Per questo nel suo protocollo FDA richiede «una descrizione dettagliata del dispositivo, compresi i componenti del dispositivo» tra cui «i fattori limitanti del dispositivo (ad es. livello di saturazione dell’ibridazione e numero massimo di cicli di amplificazione e rilevamento, ecc.)».
PROVVEDIMENTO “OMBRELLO” PER I TEST RT-PCR MENO AFFIDABILI
Come abbiamo in una precedente inchiesta basata sulla denuncia di un’associazione americana di medici e di vittime di reazioni avverse da vaccini, proprio l’alterazione dei cicli di amplificazione rappresentava un elemento in grado di produrre “falsi positivi”.
Nell’azione legale contro il Dipartimento della Salute degli Usa i denuncianti avevano mostrato tutti i test superiori a 40 cicli di amplificazione (tra cui quello degli stessi CDC), ritenuta una soglia inaffidabile perché capace di individuare la positività a qualsiasi batterio persino dal virologo accademico Giorgio Palù, poi nominato presidente dell’Agenzia Italiana del Farmaco.
Ecco perché, dopo la richiesta di ritiro dei test RT PCR formulata dai CDC, «il 15 novembre 2021, la FDA ha emesso un EUA ombrello per alcuni test molecolari RT-PCR, sviluppati da laboratori, per il rilevamento di acido nucleico da SARS-CoV-2 da campioni respiratori nasali anteriori da utilizzare come parte di un test seriale programma, che soddisfano determinati criteri di ammissibilità specificati nell’EUA. In base a questo EUA, i test autorizzati possono essere utilizzati con campioni nasali anteriori singoli o raggruppati per testare individui, compresi individui senza sintomi o altri motivi epidemiologici per sospettare COVID-19, se testati almeno una volta alla settimana».
Pertanto sono stati ritenuti validi solo come campionatura di massima se effettuati «a intervalli regolari come parte di un programma di test implementato da scuole, luoghi di lavoro o gruppi comunitari».
Il 23 settembre 2021, la FDA ha rivisto gli EUA di alcuni test molecolari, antigenici e sierologici per stabilire ulteriori condizioni di autorizzazione in risposta al continuo emergere di nuove varianti di SARS-CoV-2.
La FDA ha stabilito che è necessario stabilire condizioni aggiuntive per mitigare il potenziale rischio di risultati falsi negativi a causa della ridotta sensibilità o della non reattività associata alle mutazioni virali SARS-CoV-2: «Gli sviluppatori di test autorizzati che rientrano nell’ambito della revisione sono ora tenuti a monitorare regolarmente le mutazioni virali emergenti e il loro potenziale impatto sulle prestazioni dei test SARS-CoV-2 autorizzati».
Non si fa però il minimo accenno al rischio esattamente opposto: ovvero l’elaborazione di esiti con falsi positivi. Ma di questo riferiscono tutti i laboratori nei loro Fact Sheet, anche il produttore del test di Amazon.
I RISCHI DI FALSI POSITIVI NEI “NUOVI” RT- PCR
Il test UCSD EXCITE COVID-19 è autorizzato per l’uso con campioni di tampone nasale anteriore raccolti da individui quando ritenuto appropriato da un operatore sanitario, inclusi individui senza sintomi o altri motivi per sospettare COVID-19. Viene prodotto dalla UCSD Biomedical Sciences di La Jolla, CA, assai premurosa nel definire benefici e rischi del suo test.
«Un risultato positivo del test per COVID-19 indica che è stato rilevato l’RNA di SARS-CoV-2 e quindi il paziente è infetto dal virus e si presume che sia contagioso. I risultati dei test di laboratorio devono essere sempre considerati nel contesto delle osservazioni cliniche e dei dati epidemiologici (come i tassi di prevalenza locali e le attuali sedi di focolai/epicentri) nel fare una diagnosi finale e le decisioni sulla gestione del paziente. La gestione del paziente deve essere effettuata da un operatore sanitario e seguire le attuali linee guida CDC» scrive il laboratorio diagnostico che ha ottenuto l’autorizzazione di emergenza FDA il 17 dicembre 2021.
«Il test UCSD EXCITE COVID-19 è stato progettato per ridurre al minimo la probabilità di risultati del test falsi positivi. Tuttavia, è ancora possibile che questo test possa dare un risultato falso positivo, anche se utilizzato in luoghi in cui la prevalenza è inferiore al 5%».
Ma la UCSD Biomedical Sciences ci tiene ad avvertire gli utilizzatori: «In caso di un risultato falso positivo, i rischi per i pazienti potrebbero includere quanto segue: una raccomandazione per l’isolamento del paziente, il monitoraggio dei sintomi della famiglia o di altri contatti stretti, isolamento del paziente che potrebbe limitare il contatto con la famiglia o gli amici e può aumentare il contatto con altri pazienti potenzialmente COVID-19, limiti nella capacità di lavorare, diagnosi e trattamento ritardati per la vera infezione che causa i sintomi, prescrizione non necessaria di un trattamento o terapia o altri effetti avversi non intenzionali».
Analogo l’avvertimento del George Washington University Public Health Laboratory di Washington, DC, sul loro tampone PCR autorizzato il 3 dicembre 2021: « I risultati positivi sono indicativi della presenza di SARS-CoV-2 RNA; è necessaria una correlazione clinica con l’anamnesi del paziente e altre informazioni diagnostiche per determinare lo stato di infezione del paziente. I risultati positivi non escludono l’infezione batterica o la coinfezione con altri virus. L’agente rilevato potrebbe non essere la causa definitiva della malattia. I laboratori negli Stati Uniti e nei suoi territori sono tenuti a segnalare tutti i risultati positivi alle autorità sanitarie pubbliche competenti».
FALSI POSITIVI AL COVID-19 DAI TEST DOMESTICI. FDA ritira più di 2milioni di Kit negli USA
Ed è simile anche quello della società di diagnostica STS Lab Holdco che produce l’Amazon Multi-Target SARS-CoV-2 Real-Time RT-PCR DTC Test, un tampone rinofaringeo domestico da eseguire prelevando autonomamente la sostanza biologica per poi spedirla ai laboratori che danno una risposta in 24 ore, ma successivamente autorizzato il 17 dicembre 2021 con ben 4 differenti EUA anche per un uso non solo casalingo.
«C’è una piccola possibilità che questo test possa dare un risultato positivo sbagliato (un risultato falso positivo) in particolare se usato in una popolazione senza molti casi di infezione da COVID-19» si legge nell’informativa del laboratorio di Amazon.
https://www.gospanews.net/2021/11/28/wuhan-gates-43-omicron-variante-per-la-quarta-dose-di-vaccini-altra-mutazione-o-nuovo-genotipo-del-sars-cov-2-da-laboratorio/
La stessa società poi giustamente specifica un particolare valido per tutti i tamponi RT PCR: «Questo test non è ancora stato approvato o autorizzato dalla FDA degli Stati Uniti. La FDA può rilasciare un’autorizzazione all’uso di emergenza (EUA) quando vengono soddisfatti determinati criteri, che include l’assenza di alternative adeguate, approvate e disponibili. L’EUA per questo test è supportata dalla dichiarazione del Segretario della Salute e del Servizio Umano (HHS) secondo cui esistono circostanze che giustificano l’uso di emergenza della diagnostica in vitro per l’individuazione e/o la diagnosi del virus che causa il COVID-19».
LA FORTUNATA SCOMMESSA DI AMAZON SU OMICRON
«Amazon ha limitato le vendite dei suoi kit di test Covid-19 a casa a causa di un’impennata della domanda legata ai timori intorno alla variante Omicron a rapida diffusione» ha scritto Annie Palmer sul sito del network televisivo della CNBC. Ma oggi abbiamo fatto una verifica su Amazon ed il test RT PCR risulta momentaneamente non più disponibile.
«Ci sono state segnalazioni diffuse di lunghe file nei siti di test Covid, mentre gli scaffali di alcune farmacie di test Covid a domicilio sono diventati nudi. In risposta all’aumento, Walgreens e CVS Health hanno dichiarato martedì che stavano limitando il numero di test Covid a domicilio che i clienti possono acquistare sia in negozio che online» ha scritto la reporter della tv americana.
Un portavoce di Amazon ha dichiarato alla CNBC che la società sta riscontrando carenze di inventario di alcuni test Covid a causa dell’aumento della domanda. La società sta lavorando per ottenere ulteriori scorte di test Covid dai suoi partner di vendita, ha affermato il portavoce.
A partire da mercoledì, Amazon ha limitato il numero di acquisti del proprio kit di test PCR a domicilio a 10 unità per acquirente. Ma ciò non è bastato ad esaurire le richieste che hanno causato il momentaneo “sold out”
La scarsità di test arriva quando il presidente Joe Biden ha detto martedì che il governo acquisterà 500 milioni di test a domicilio che gli americani possono ordinare online gratuitamente. La consegna dei kit inizierà il mese prossimo. C’è da scommettere che da allora ci sarà una nuova impennata di contagi.
Ma certamente nessuna autorità sanitaria, intrigata nel colossale business dei vaccini antiCovid, si farà carico di verificare quanti sono i contagiati sintomatici e quanti gli asintomatici, ovvero potenzialmente tutti falsi positivi…
Solo in Tanzania erano stati testati i tamponi RT-PCR con il sorprendente risultato che avevano trovato positiva al Covid-19 una papaya e una capra.
Per una curiosa coincidenza furono donati all’OMS africana dalla fondazione del proprietario di Alibaba, la piattaforma di e-Commerce leader in Asia che grazie ai lockdown imposto per mesi a molti esercizi commerciali in tutto il mondo incrementò notevolmente il suo fatturato. Proprio come Amazon…
Carlo Domenico Cristofori
© COPYRIGHT GOSPA NEWS
divieto di riproduzione senza autorizzazione
segui Gospa News su Telegram
MAIN SOURCES
GOSPA NEWS – WUHAN.GATES REPORTAGE
GOSPA NEWS – INCHIESTE CORONA VIRUS
FDA – In Vitro Diagnostics EUAs – Molecular Diagnostic Tests for SARS-CoV-2
https://www.gospanews.net/2021/12/22/pfizer-sponsor-pure-dei-procuratori-usa-lobbying-da-1milione-di-dollari-alla-conference-attorneys-general-altri-8-a-1-842-politici-bipartisan/



2 pensieri su “COVID, FDA SCONFESSA CDC: OK A TAMPONI RT-PCR COI “RISCHI FALSI POSITIVI”. Esauriti Test Amazon: Affaroni su Omicron!”