di Fabio Giuseppe Carlo Carisio
La velocità con cui vengono sfornati gli aggiornamenti dei vaccini booster, ovvero le dosi aggiuntive rispetto alle 2 iniziali. è tale che gli aspetti burocratici delle autorizzazioni si incrociano in un groviglio a volte davvero difficile da interpretare.
Fino a qualche mese fa le autorizzazioni per i sieri genici sperimentali a base di RNA messaggero delle case farmaceutiche americane Moderna e Pfizer (con la tedesca Biontech) seguivano dei processi abbastanza lenti, graduali e rigorosi per i trial clinici. Dalla scorsa estate in poi anche le approvazioni delle autorità sanitarie hanno messo il turbo e si fatica davvero a stare dietro ai continui aggiornamenti.
https://www.gospanews.net/2023/02/12/nel-piano-di-immunizzazione-dei-bimbi-i-booster-covid-testati-solo-sui-topi-clamorosa-scelta-di-potente-autorita-sanitaria/
Alcuni giorni fa la Food and Drug Administration (FDA), l’ente americano regolatore dei farmaci, ha approvato i vaccini antiCovid bivalenti anche per i bambini dai 6 mesi a 5 anni dopo che erano stati autorizzati per gli adulti sebbene un recentissimo studio tedesco avesse comprovato maggiori e più gravi reazioni avverse (rispetto ai booster monovalenti) tra 76 operatori sanitari che erano stati monitorati.
«A seguito dell’autorizzazione da parte di EMA e AIFA, nell’ambito della campagna di vaccinazione anti SARS-CoV-2/COVID-19, è ora disponibile anche la formulazione bivalente original/omicron BA.4-5 del vaccino Spikevax. Pertanto, tenuto conto del parere della CTS di AIFA, le raccomandazioni già in essere sull’utilizzo delle formulazioni bivalenti dei vaccini a m-RNA (original/omicron BA.1 di Spikevax e Comirnaty, e original/BA.4-5 di Comirnaty) si estendono anche a tale formulazione».
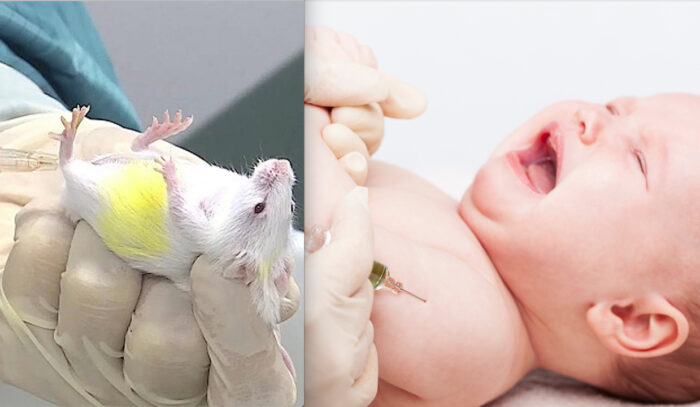
Con queste parole il direttore generale del Ministero della Salute, Giovanni Rezza, senza dettagliate specificazioni sull’età dei destinatari, il 9 dicembre ha raccomandato l’utilizzo dei nuovi booster che, come emerso da un’attenta analisi della documentazione rilasciata da Pfizer, prima dell’autorizzazione EUA sono stati sperimentati solo sui topi e non con gli indispensabili e ordinari trial clinici sugli esseri umani che si sottopongono al monitoraggio quali cavie consapevoli e ben remunerate.
Per fare più in fretta, e risparmiare soldi nonostante i guadagni miliardari sul business dei vaccini antiCovid, le Big Pharma hanno infatti saltato questo passaggio forse già consapevoli che i CDC (Centers of Diseases Control and Prevention), la massima autorità sanitaria USA in materia epidemiologica, avrebbero sollecitato l’approvazione di emergenza (EUA) alla FDA.
La circostanza è venuta a galla per uno scambio di email intercettato dai media che ha scatenato violente proteste contro CDC e FDA, già finiti in altri scandali per una precedente approvazione dei sieri genici per uso pediatrico e per il mancato rilascio dei dati sulle reazioni avverse aggiornate derivanti dalla farmacovigilanza attiva.
E’ bene ricordare innanzitutto che i bambini, secondo le statistiche concernenti i decessi per Covid-19, corrono pochissimi rischi in caso di contagio e raramente sviluppano una patologia sintomatica grave come attestano i numeri dell’Istituto Superiore della Sanità di Roma. Mentre i dati non sui malori avversi tra i giovanissimi vaccinati, sebbene non ufficiali ma frutto di inchieste giornalistiche, sono ormai inquietanti.
IL MISTERO DEI BIVALENTI PER I BAMBINI IN EUROPA
In questo ginepraio di conflitti d’interessi e forzature normative, come scrive l’affidabile sito di medicina Doctor 33, l’approvazione dei bivalenti da parte della FDA è stata «recepita da una circolare del ministero della Salute che sottolinea come “tenuto conto del parere della Cts”, Commissione tecnico scientifica “di Aifa, “si estendono anche a tale formulazione – si legge nella circolare – le raccomandazioni già in essere sull’utilizzo delle formulazioni bivalenti dei vaccini a mRna” già disponibili, cioè le versioni “original/Omicron BA.1 di Spikevax” e di “Comirnaty*” di Pfizer/BioNTech, e la versione “original/BA.4-5 di Comirnaty”».
Ma mentre da Roma arrivavano queste “rassicuranti” comunicazioni la Pfizer aveva reso noto l’8 dicembre, nel comunicato sull’approvazione FDA dei bivalenti per i bambini under 5, di aver chiesto un’autorizzazione specifica all’EMA proprio sull’uso per i piccoli di tale fascia.
Sebbene la stessa European Medicines Agency di Amsterdam, regolatore dei farmaci per tutti i paesi UE, si fosse espressa in data antecedente il 6 dicembre: «L’Emergency Task Force (ETF) dell’EMA ritiene che i vaccini bivalenti mRNA adattati mirati al ceppo originale e alle sottovarianti Omicron BA.4-5 di SARS-CoV-2 possano essere utilizzati per la vaccinazione primaria (iniziale). Questi vaccini sono attualmente autorizzati solo come richiamo. (…) L’ETF ha pertanto ritenuto che i vaccini bivalenti originali/Omicron BA.4-5 possano essere utilizzati in bambini e adulti precedentemente non vaccinati» (testo integrale in calce all’articolo).
Qualcosa non torna! Perché il CEO di Pfizer Albert Bourla ha spiegato l’8 dicembre di aver inoltrato la richiesta a EMA se la stessa 2 gg prima aveva già risposto?
L’interpretazione possibile è soltanto una: mentre in Europa e in Italia si fa rientrare in un unico calderone l’approvazione sui bivalenti per adulti e bambini, senza distinzione di età, la Big Pharma di New York si attende un pronunciamento “specifico” che vada oltre la “raccomandazione generica” affinché possa preservarla da eventuali cause legali da parte dei genitori di neonati di 6 mesi eventualmente uccisi dal bivalente.
Esso, infatti, è stato inizialmente autorizzato solo dopo la sperimentazione sui topi e solo successivamente “testato al vivo” sugli adulti, a cui è stato somministrato dopo l’ok FDA all’uso di emergenza, ma per i quali esiste un monitoraggio sulle reazioni avverse di poche settimane e pertanto non certo paragonabile ai trial clinici ordinari che durano mesi.
Ecco spiegato perché il comunicato del Ministero della Salute, guidato dal ministro Orazio Schillaci che è pioniere delle ricerche sulle terapie geniche mRNA in Italia, non porta distinzioni tra bivalenti per adulti e per bambini.
Ma la questione ancora più allarmante è un’altra. Ciò è avvenuto nello stesso momento in cui le autorità sanitarie hanno approvato la dose booster, ovvero la terza monovalente, anche per i bambini più piccoli.
IL CAOS SU MONOVALENTI E BIVALENTI PER I BAMBINI
Pertanto non è stata fatta la minima distinzione tra la dose “monovalente” e quella “bivalente” sebbene siano due prodotti di biotecnologia farmacologica differenti.
Nello stesso giorno (9 dicembre 2022) in cui il dottor Rezza rilasciava il comunicato ministeriale sui bivalenti per gli adulti diffondeva infatti anche quello per il monovalente per i più piccoli:
«Anche i bambini sotto i 5 anni potranno vaccinarsi con il vaccino anti-covid di Pfizer-BioNTech, lo prevede una nuova circolare del ministero della Salute. In particolare, la somministrazione è rivolta alla fascia d’età compresa tra i 6 mesi e i 4 anni, ovvero a coloro “che presentino condizioni di fragilità, tali da esporli allo sviluppo di forme più severe di infezione da Sars-Cov-2“. Nel documento che porta la firma di Giovanni Rezza, direttore generale della Prevenzione, sono anche elencate una serie di patologie o condizioni che determinano questa fragilità» ha riportato anche SkyTG24 Salute e Benessere.
“Tenuto conto dell’indicazione di utilizzo autorizzate” dalle agenzie del farmaco europea e italiana “Ema e Aifa, tale vaccino potrà essere reso disponibile anche per la vaccinazione dei bambini, nella fascia di età 6 mesi-4 anni (compresi), che non presentino tali condizioni, su richiesta del genitore o di chi ne ha la potestà genitoriale”, si legge nel documento ministeriale.
Spiega la circolare che la Commissione tecnico scientifica dell’Aifa, “in data 24 ottobre 2022, accogliendo il parere espresso dall’Ema, ha approvato l’estensione di indicazione di utilizzo del vaccino Comirnaty (BioNTech-Pfizer) nella specifica formulazione da 3 microgrammi/dose, per la fascia di età 6 mesi-4 anni (compresi)”.
“Comirnaty 3 microgrammi/dose viene somministrato per via intramuscolare dopo diluizione come ciclo primario di 3 dosi (da 0,2 mL ciascuna) con la seconda dose a 3 settimane dalla prima dose, e la terza dose almeno 8 settimane dopo la seconda. Se il bambino compie 5 anni tra una dose e l’altra nel corso del ciclo di vaccinazione, dovrà completare il ciclo continuando a ricevere la dose di 3 microgrammi)” aggiunge la nota del direttore generale del Dicastero della Salute.
Inoltre, tenuto conto del parere espresso dal Gruppo di lavoro permanente sull’infezione da Sars-CoV-2 del Consiglio superiore di sanità il 16 novembre 2022, l’avviso è esteso ai bambini che presentino determinate condizioni di fragilità. Ovvero: “Grave immunodeficienza primitiva, (per esempio immunodeficienza comune variabile, agammaglobulinemia di Bruton, Sindrome di Wiskott-Aldrich, S. di DiGeorge) o secondaria, compresi coloro che sono in trattamento per cancro o che sono sottoposti a trattamento immunosoppressivo per malattie immuno-mediate (collagenopatie, malattia di Crohn), o per la prevenzione del rigetto nel trapianto di organo solido, o bambini affetti da Hiv con conta di linfociti CD4+ inferiore a 200 elementi/mL; trapianto di midollo osseo/cellule staminali, o terapia con Car-T cells; terapia con anticorpi depletanti il compartimento B cellulare; splenectomizzati o soggetti nati con asplenia; Thalassemia Major, anemia a cellule falciformi e altre anemie croniche gravi; insufficienza cardiaca grave; ipertensione polmonare grave; difetti cardiaci cianotici congeniti, cuore univentricolare post-intervento di Fontan e altre malattie cardiache congenite complesse che hanno impatto sulla funzione cardiaca”.
Peccato che molteplici studi scientifici e autorevoli esperi americani come la biofisica americana Stephanie Seneff e il medico Peter McCullough e il chirurgo milanese Andrea Stramezzi hanno evidenziato che proprio le persone più fragili e gli anziani sono esposti al rischio di un esacerbato danneggiamento dei loro sistemi immunitari già indeboliti per cause pregresse, come confermano il boom di riattivazioni di forme gravi di Herpes pochi giorni dopo la somministrazione dei vaccini.
I nuovi sieri genici aggiornati sono stati approvati dopo una sperimentazione sui topi nonostante i casi fatali delle versioni originali registrati dalla farmacovigilanza passiva (cioè senza successivo montaggio dei singoli casi in follow-up che è previsto solo dal quella attiva) rilevabile dalle piattaforme di raccolta delle segnalazioni di effetti indesiderati come EudraVigilance (dell’European Medicines Agency – EMA) o dei CDC USA.
Comincia a prendere forma il piano di depopolamento mondiale dei bambini più fragili e dei costosi pensionati finalizzato al transumanesimo eugenetico voluto dal Nuovo Ordine Mondiale che ha creato il SARS-Cov-2 in laboratorio per poter diffondere l’imposizione massiva dei vaccini?
Fabio Giuseppe Carlo Carisio
© COPYRIGHT GOSPA NEWS
divieto di riproduzione senza autorizzazione
segui Gospa News su Telegram
MAIN SOURCES
GOSPA NEWS – INCHIESTE CORONA VIRUS
GOSPA NEWS – WUHAN.GATES REPORTAGE
MINISTERO DELLA SALUTE – APPROVAZIONE BIVALENTI
DOCTOR 33 – Covid-19, ok Fda a vaccini bivalenti Omicron 4-5 per bambini da sei mesi a cinque anni
SKYTG24 SALUTE E BENESSERE – Covid, via libera a vaccino Pfizer per i bambini under 5
MINISTERO DELLA SALUTE – APPROVAZIONE BOOSTER DA 6 MESI A 4 ANNI
IL COMUNICATO EMA DEL 6 DICEMBRE 2022
L’Emergency Task Force (ETF) dell’EMA ritiene che i vaccini bivalenti mRNA adattati mirati al ceppo originale e alle sottovarianti Omicron BA.4-5 di SARS-CoV-2 possano essere utilizzati per la vaccinazione primaria (iniziale). Questi vaccini sono attualmente autorizzati solo come richiamo.
Nel giungere a questa conclusione, l’ETF ha esaminato gli studi di laboratorio (non clinici) e i dati sulla risposta immunitaria a seguito di infezione naturale con Omicron BA.4-5 in persone non vaccinate che non erano state precedentemente infettate da SARS-CoV-2.
I dati suggeriscono che la vaccinazione primaria con questi vaccini bivalenti adattati dovrebbe dare origine a un’ampia risposta immunitaria nelle persone che non sono state ancora esposte o vaccinate contro SARS-CoV-2.
L’ETF ha inoltre osservato che il profilo di sicurezza dei vaccini adattati quando usati come richiamo è paragonabile a quello dei vaccini a mRNA originali, per i quali il profilo di sicurezza è ben consolidato.
L’ETF ha pertanto ritenuto che i vaccini bivalenti originali/Omicron BA.4-5 possano essere utilizzati in bambini e adulti precedentemente non vaccinati.
Sulla base di queste considerazioni, le autorità nazionali possono decidere di utilizzare questi vaccini bivalenti adattati per la vaccinazione primaria nelle loro campagne di vaccinazione nazionali, qualora si rendesse necessario. Ulteriori ricerche cliniche e studi osservazionali dovrebbero fornire ulteriori informazioni sulla sicurezza e l’efficacia dei vaccini bivalenti per la vaccinazione primaria.
La dichiarazione dell’ETF è stata rilasciata nel contesto delle sue attività di risposta alle emergenze sanitarie pubbliche. Non riflette una modifica alle informazioni sul prodotto dei vaccini autorizzati.